
Hemostato Fluido D-Stat®
Se ha demostrado que reduce la frecuencia de formación de hematomas clínicamente relevantes en implantes del generador de pulso1,2,3
Compuesto por colágeno, trombina y un diluyente amortiguado, este procoagulante espeso pero fluido facilita la hemostasia al iniciar los propios mecanismos de coagulación del cuerpo.
Ventajas prácticas
- El kit completamente estéril permite la preparación completa dentro del campo estéril
- Mezcla fácil y libre de agujas
- No se requiere almacenamiento de farmacia
El Pocket Protector Study demostró un 48% de reducción en hematomas clínicamente relevantes1,2,3
El Pocket Protector Study se trató de un estudio clínico aleatorio y posible que evaluaba la incidencia de la formación de hematomas clínicamente relevantes después de los implantes del generador de pulso con el Hemostato Fluido D-Stat® junto con el estándar de cuidado en comparación con el estándar de cuidado solo.4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*Reducción estadísticamente significativa (p ≤ 0.05) que se calculó con la Prueba Exacta de Fischer. |
|||
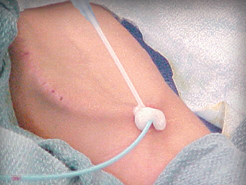
Hemostato Fluido D-Stat® para utilizar en sitios de acceso vascular
Se aplica tópicamente para controlar la hemorragia de los sitios de acceso vascular y los catéteres y tubos percutáneos.
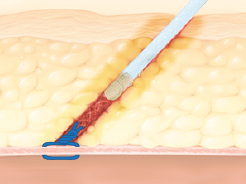
Hemostato Fluido D-Stat® para utilizar en la hemostasia del tubo de tejidos después del dispositivo de cierre vascular
Se aplica como un tratamiento de complemento para sellar el filtrado residual de tubos de tejidos de los sitios de acceso femorales que los dispositivos hemostáticos basados en colágeno/sutura habían cerrado previamente.
Referencias:
- Slotwiner D, Alder S, Fuenzalida C, McCowan R, et al. The Pocket Protector Study: Use of D-Stat® Flowable Hemostat in Pulse Generator Pectoral Pockets Reduces the Rate of Clinically Relevant Hematomas. Circulation. 2007;116:II_678 (the "Pocket Protector Study").
- El Pocket Protector Study evaluó a 269 pacientes de alto riesgo, que se definieron como aquellos que reanudaban sus regímenes de anticoagulación en el plazo de 24 horas. Estos regímenes incluyeron la administración de uno o más de los siguientes medicamentos: Heparina, HBPM, Coumadin®, Plavix®. Para los pacientes que reciben una terapia de Coumadin, se requirió una razón normalizada internacional (INR) de < 2.0.
- Las formas de los hematomas varían según los planos de los tejidos que se diseccionan. En el Pocket Protectory Study la siguiente fórmula se utilizó para identificar los hematomas de bolsillo clínicamente relevantes. "Longitud, ancho y altura de cualquier hematoma palpable de la cantidad aproximada de sangre presente con la siguiente fórmula para el volumen de un elipsoide: V = (1/6) π (L)(W)(H). Donde: V = Volumen, L = Longitud (cefálica/caudal), W = Ancho (promedio/lateral) y H = Altura (anterior al generador de pulsos)". "Basado en esta fórmula, el volumen de sangre presente en un hematoma que mide 8 x 1 x 2 (cm) (L,W,H) es aproximadamente 8.5 ml, por lo tanto, este volumen debe servir como el volumen mínimo para un hematoma clínicamente relevante".
- El Pocket Protector Study definió el estándar de cuidado como compresas sin tratar, electrocauterización o compresión.
El Hemostato Fluido D-Stat® se indica para usar como un tratamiento de complemento para sellar el filtrado residual de tubos de tejidos de los sitios de acceso femorales que los dispositivos hemostáticos basados en colágeno/sutura habían cerrado previamente.
El Hemostato Fluido D-Stat® se indica para usar en pacientes anticoagulados de alto riesgo que se someten al implante de un generador de pulsos (por ejemplo, un marcapasos o DCI) para reducir la frecuencia de formación de hematomas clínicamente relevante en el bolsillo prepectoral. Los pacientes de alto riesgo se definen como aquellos cuyos regímenes de anticoagulación se reanudarán en el plazo de 24 horas después del implante. Los hematomas clínicamente relevantes se definen como aquellos que son el resultado de una alteración en el estándar del resultante del cuidado de la formación de hematomas incluida la alteración (es decir, suspensión o interrupción) del régimen de terapia del anticoagulante (Heparina, HBPM, Coumadin® o Plavix®), aplicación de un vendaje de compresión y evacuación del hematoma.
El Hemostato Fluido D-Stat® se contraindica en personas con sensibilidad conocida a materiales derivados de bovinos.
ADVERTENCIA:
COMPLICACIONES DE TROMBOSIS Y HEMORRAGIA SEVERA
- THROMBIN-JMI® puede causar
trombosis o hemorragia severa fatal. La trombosis puede ser resultado de
un desarrollo de
anticuerpos contra la trombina bovina. La hemorragia puede ser resultado
de un desarrollo de
anticuerpos contra el factor V. Estos pueden tener reacciones cruzadas
con el factor humano V y
llevar a su deficiencia.
- No volver a exponer a pacientes a THROMBIN-JMI® si se
conoce o se sospecha de
anticuerpos contra la trombina bovina o el factor V.
- Monitoree a los pacientes para saber los valores de laboratorio de
coagulación anormal,
hemorragia o trombosis.
PRECAUCIÓN: Las leyes federales de los Estados Unidos restringen la venta de este dispositivo por parte de un médico clínico o por pedido de este.
Plavix es una marca comercial registrada de Sanofi-Societe Anonyme.
Coumadin es una marca comercial registrada de Bristol-Myers Squibb Pharma Company.
THROMBIN-JMI es una marca comercial registrada de King Pharmaceuticals Research and Development, LLC.
Teleflex, el logotipo de Teleflex y D-Stat son marcas comerciales o marcas comerciales registradas de Teleflex Incorporated o sus afiliadas, en los EE. UU. o en otros países. MC-005114